日本肺癌学会バイオマーカー委員会編 肺癌患者におけるバイオマーカー検査の手引き. 2. バイオマーカー検査の流れとマルチプレックス遺伝子検査(2024 年 9月改訂版)

- 今日は 非小細胞肺癌(NSCLC) における 分子標的治療と遺伝子検査 について、解説していきます。
- NSCLC にはさまざまなドライバー遺伝子異常が存在し、それを狙った分子標的治療が非常に有効 であることがわかっています。そこで重要になるのが「遺伝子検査」です。
- では、具体的にどんな流れで診断・治療が行われるのか、詳しく見ていきましょう!
はじめに
治療選択におけるドライバー遺伝子検査の重要性
進行・再発NSCLCの患者さんにおいては、原発や転移組織、細胞診やそのセルブロックなどを用いて、初回治療前に以下の検査が推奨されています。
- ドライバー遺伝子異常の有無
- PD-L1の発現状況
この結果をもとに、初回治療や二次治療以降で 適切な分子標的治療薬を選択 することが重要です。
また、最近では 周術期においても、EGFR変異やALK融合遺伝子、PD-L1発現状況 を考慮した 術前・術後補助療法 が検討されるようになりました。
遺伝子検査の進化:単一検査からマルチ遺伝子検査へ
以前は、各遺伝子を 1つずつ検査 する「単一(シングルプレックス)遺伝子検査」が主流でした。しかし、診断すべき遺伝子が増えるにつれ、より効率的な マルチプレックス(マルチ)遺伝子検査 へと移行しています。
🔍 マルチ遺伝子検査のメリット
- 一度の検査で複数の遺伝子異常を同時に解析できる
- 検体(組織や血液)の使用量を最小限に抑えられる
- 診断にかかる時間を短縮できる
現在では、次世代シークエンシング(NGS) を用いた 網羅的な遺伝子パネル検査 も広まりつつあり、より精密な治療戦略の選択が可能になっています。
小括
✅ NSCLCでは、ドライバー遺伝子異常に基づく分子標的治療が主流
✅ 初回治療前の遺伝子検査(ドライバー遺伝子+PD-L1発現)は必須
✅ 周術期治療においても遺伝子情報を考慮する時代に
✅ 単一遺伝子検査からマルチ遺伝子検査(NGSなど)へのシフトが進行中
NSCLCにおけるバイオマーカー検査の流れ
分子標的治療薬とコンパニオン診断薬(CDx)とは?
進行・再発NSCLC では、多くの 分子標的治療薬 が承認されています。ただし、これらの薬を使用するには 「適応となる遺伝子異常があるかどうか?」 を事前に確認する必要があります。
この診断に用いられるのが CDx です。
📌 2024年9月時点 で承認されている分子標的治療薬と、それに対応するCDxは 表1 にまとめられています。
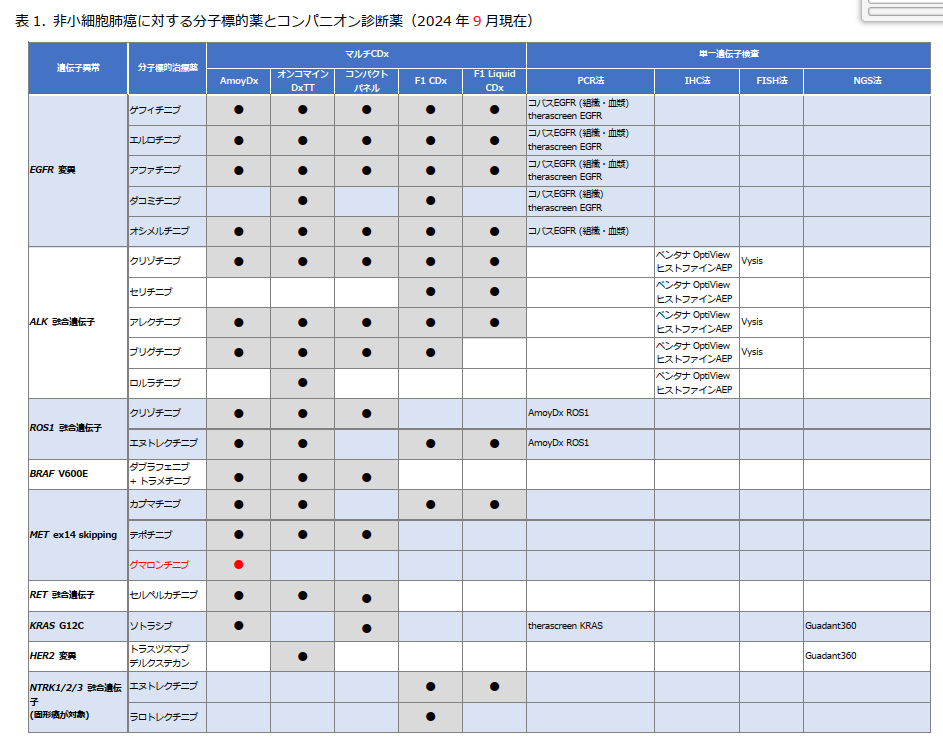
日本肺癌学会バイオマーカー委員会編 肺癌患者におけるバイオマーカー検査の手引き. 2. バイオマーカー検査の流れとマルチプレックス遺伝子検査(2024 年 9月改訂版)より引用
コンパニオン診断の進化
以前は、単一遺伝子検査(1回の検査で1つの遺伝子異常を調べる方法)が主流でした。具体的には以下のような方法が使われていました。
- PCR(Polymerase Chain Reaction)法:特定の遺伝子変異を検出
- IHC(免疫組織化学染色)法:タンパク発現を可視化
- FISH(Fluorescence In Situ Hybridization)法:染色体異常を蛍光で検出
上記の検査は基本的には単一のバイオマーカーしか評価できません。
そのため、診断すべき遺伝子の数が増えたことにより、複数の遺伝子異常を一度に調べられる「マルチCDx」 へと移行しています。
代表的なマルチCDx
2019年以降、日本では NGS や PCR を用いた マルチCDx が登場し、保険適用となっています。
| 保険収載年 | マルチCDxの名称 | 方法 |
|---|---|---|
| 2019年6月 | オンコマイン Dx Target Test マルチCDx(オンコマイン DxTT) | NGS |
| 2019年6月 | FoundationOne CDx がんゲノムプロファイル(F1CDx) | NGS |
| 2021年8月 | FoundationOne Liquid CDx(F1LiquidCDx) | 血液検体(リキッドバイオプシー) |
| 2022年1月 | AmoyDx 肺癌マルチ遺伝子 PCR パネル(AmoyDx) | PCR |
| 2023年2月 | 肺がんコンパクトパネルDx マルチコンパニオン診断システム(肺がんコンパクトパネル) | NGS |
これらのCDxは、一度の検査で複数の遺伝子異常を調べられる という大きなメリットがあり、現在の主流となっています。

CDxに対応する遺伝子は今後さらに追加される予定であり、最新の承認状況は定期的にチェックすることが大切 です。
📌 最新情報の確認方法 CDxの最新情報は、医薬品医療機器総合機構(PMDA)のホームページ で確認できます。
👉 「コンパニオン診断薬等の情報」(PMDAサイト)
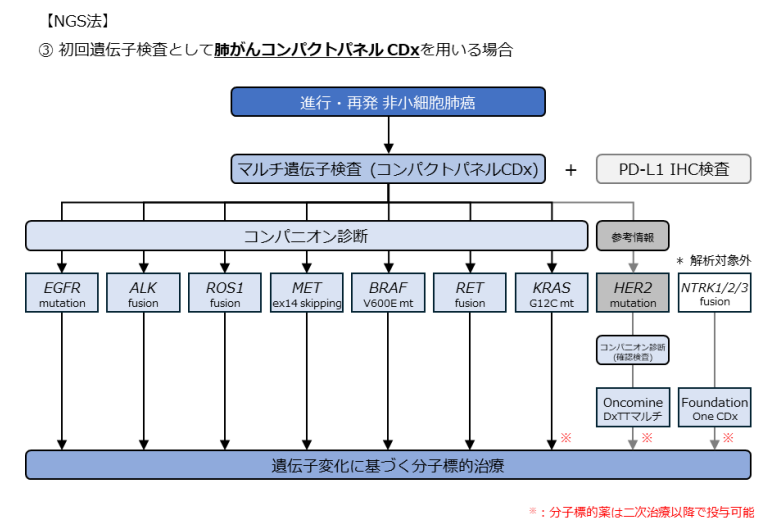
進行・再発NSCLCにおけるマルチCDxの診断アルゴリズム
- Ⅳ期NSCLC では、治療開始前にすべての対象遺伝子について(なるべく?)優先順位をつけずに診断を行うことが推奨されています。
- 従来は、単一遺伝子検査を組み合わせて診断していたものの、これには以下のデメリットがありました。
- 検体が不足する(何度も検査が必要)
- 費用がかかる
- 診断に時間がかかる
- RETやその他の遺伝子異常では、単一遺伝子検査の方法がない
これらの問題を解決するため、進行・再発NSCLCの初回治療前には、マルチCDxを用いることが強く推奨 されています。
現在の診断アルゴリズムでは、PCR法とNGS法の2つのアプローチ に分けてCDxを実施することが推奨されています。
🔹 診断の流れ
- マルチCDxの実施
- PCR法(AmoyDx) を使用する場合(下記の図を参照)
- NGS法(オンコマイン DxTT、肺がんコンパクトパネル) を使用する場合(下記の図を参照)
- PD-L1のIHC検査を併用
- PD-L1の発現状況も治療方針を決める重要な要素
- 検体が不足している場合
- マルチCDxができない場合は、単一遺伝子検査を考慮
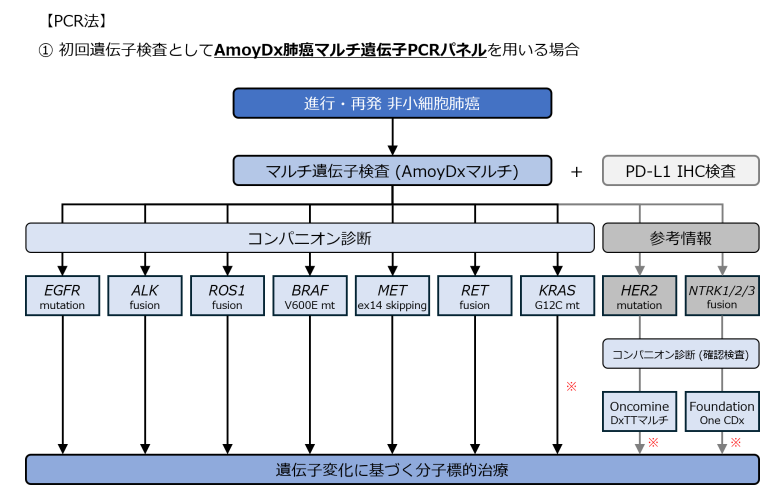
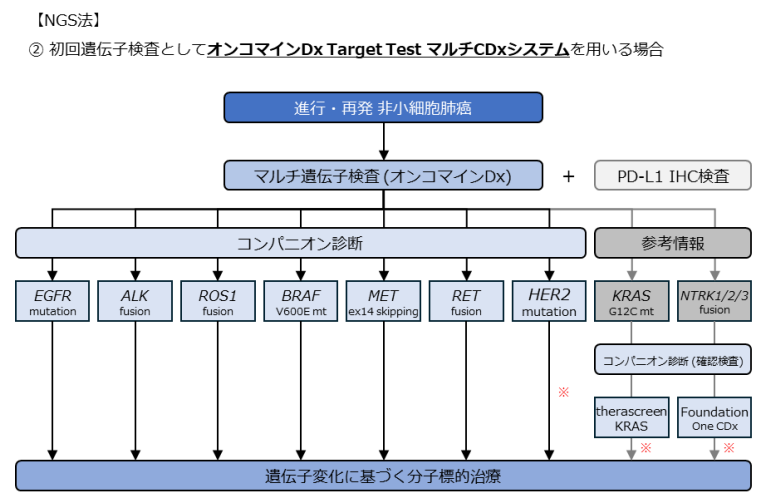
日本肺癌学会バイオマーカー委員会編 肺癌患者におけるバイオマーカー検査の手引き. 2. バイオマーカー検査の流れとマルチプレックス遺伝子検査(2024 年 9月改訂版)より引用
小括
✅ 分子標的治療薬を使用するには、対応するCDxが必須
✅ 進行・再発NSCLCでは、初回治療前にマルチCDx+PD-L1検査を推奨
✅ 適切な検査を行うためには、検体採取の段階から遺伝子診断を考慮する
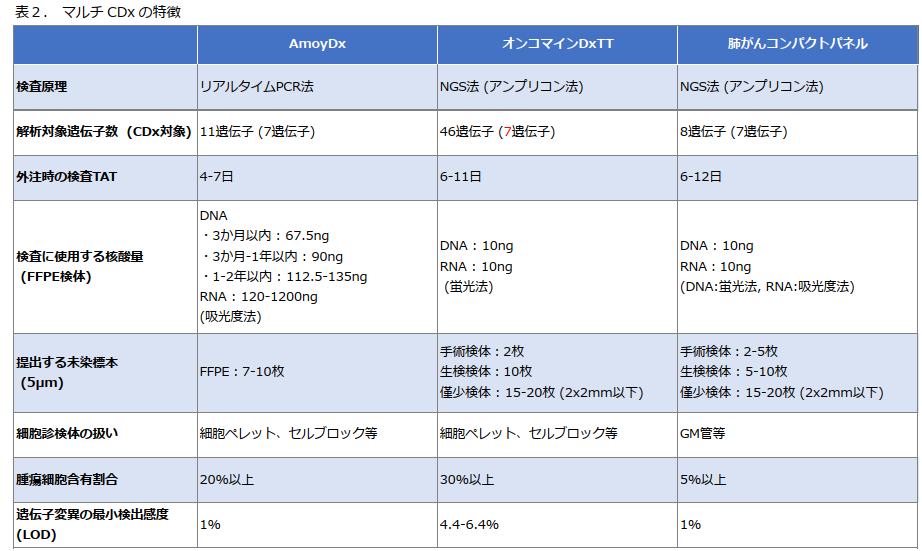
マルチCDxの特徴
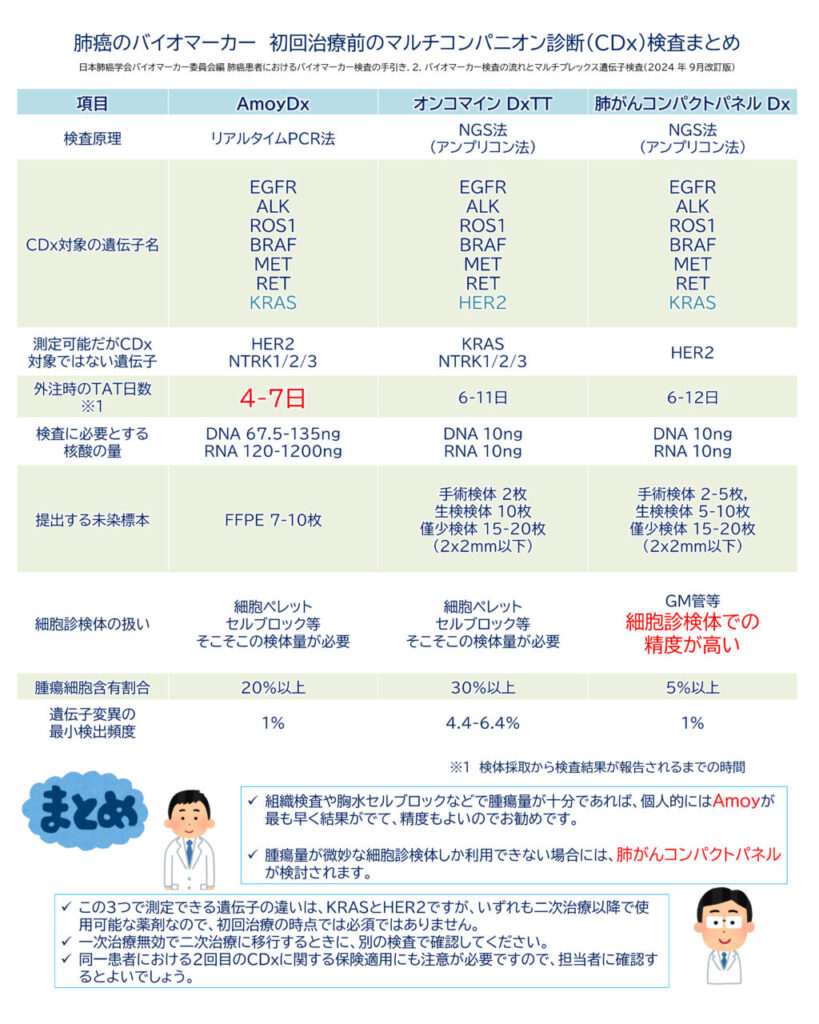
F1CDxとF1LiquidCDxは保険診療上、初回治療前のコンパニオン診断目的にはあまり使用されない ため、ここでは AmoyDx(PCRベース)、オンコマイン DxTT、肺がんコンパクトパネル に焦点を当てて解説していきます(表2を参照)。
日本肺癌学会バイオマーカー委員会編 肺癌患者におけるバイオマーカー検査の手引き. 2. バイオマーカー検査の流れとマルチプレックス遺伝子検査(2024 年 9月改訂版)より引用
マルチCDxを選ぶ際のポイント
それぞれのCDxには特徴があり、対象とする遺伝子や薬剤が異なります。
- AmoyDx(PCRベース):解析する遺伝子数は少ないが、検出感度が高く、検体提出から結果返却までの時間 (Turn-around time: TAT)が短い
- オンコマイン DxTT(NGSベース):より多くの遺伝子を解析可能
- 肺がんコンパクトパネル(NGSベース):特にNSCLCに特化した日本開発の検査。細胞診検体にも対応可能。
詳細については上記の表2や次からの項目を参照してください。
AmoyDx 肺癌マルチ遺伝子 PCR パネルの特徴
🔍 AmoyDxの特徴
- 迅速な結果(TAT約5日)
- 高い感度(LOD:Limit of Detection)
- 検査成功率が高い
- 少ない組織検体でも実施可能
検出できる遺伝子
AmoyDxでは、以下の 11遺伝子・167バリアント を一度に解析できます。
| 遺伝子 | 検出対象 |
|---|---|
| DNA解析 | EGFR(エクソン18-21変異)、BRAF(V600E)、HER2(エクソン20変異)、KRAS(コドン12, 13変異) |
| RNA解析 | ALK、ROS1、RET、NTRK1/2/3(融合遺伝子)、MET(エクソン14スキッピング) |
🔸 注意点
AmoyDxはHER2変異やNTRK融合の検出が可能 ですが、現在の保険適用では これらのコンパニオン診断薬ではないため、治療薬適応にはオンコマイン DxTTや後述のがんゲノムプロファイリングでの確認が必要 です。同一患者における2回目のCDxに関する保険適用にも注意が必要ですので、担当者にご確認ください。
NGSを用いたマルチCDx
オンコマイン Dx Target Test マルチCDx(オンコマイン DxTT)
🔍 特徴
- DNA解析(46遺伝子)
- RNA解析(21遺伝子)
- CDxとしてEGFR変異(エクソン19欠失、エクソン21 L858R変異)、ALK融合、ROS1融合、BRAF V600E変異を解析
- 2019年10月からT790MやEGFR 遺伝子の稀な変異 (uncommon mutation)、RET融合、HER2変異、METエクソン14スキッピングも追加
🔸 注意点
オンコマインDxTTはKRAS変異やNTRK融合の検出が可能 ですが、現在の保険適用では そのコンパニオン診断薬ではないため、これらの治療薬適応にはAmoyDxや肺がんコンパクトパネル Dx、therascreen® KRAS、がんゲノムプロファイリングなどでの確認が必要 です。同一患者における2回目のCDxに関する保険適用にも注意が必要ですので、担当者にご確認ください。
肺がんコンパクトパネル Dx マルチコンパニオン診断システム
🔍 特徴
- 小単位(モジュール)に分けて解析し、高感度なシーケンスが可能
- 推奨核酸量が10ng以上と比較的少ない
- 細胞診検体の使用も可能
- GM管という専用の核酸保護剤入り検体採取容器を使用
📌 2023年2月には4遺伝子(EGFR、ALK、ROS1、MET)、2024年2月にはBRAF、KRAS、RETが追加で保険適用 され、カバー範囲が広がっています。
肺がんコンパクトパネル DxはHER2変異の検出が可能 ですが、現在の保険適用では HER2変異のコンパニオン診断薬ではないため、治療薬適応にはオンコマイン DxTTやがんゲノムプロファイリングでの確認が必要 です。同一患者における2回目のCDxに関する保険適用にも注意が必要ですので、担当者にご確認ください。
小括
✅ AmoyDx(PCR)は迅速・高感度
✅ 肺癌コンパクトパネルは細胞診検体にも対応可能
✅ NGSベース(オンコマイン DxTT・肺がんコンパクトパネル)は包括的診断向き
がんゲノムプロファイリング(CGP)検査とは?
CGPは、CDxとは異なり、「特定の遺伝子変異の有無を調べる」のではなく、広範囲の遺伝子異常を包括的に解析し、治療選択の参考にする ための検査です。
🔍 ポイント
- CDxは、診断時点から使用可能 だが、CGPは標準治療が終了(または終了見込み)になった時点で実施 する
- ゲノム異常の解釈には専門家の関与が必要(がんゲノム医療中核拠点病院などでエキスパートパネルが実施)
- CGPを受けた患者のうち、実際に治療薬に到達できる割合は約10% で、今後の課題となっている
代表的なCGP検査
| 保険収載年 | 検査名 | 対象検体 |
|---|---|---|
| 2019年6月 | FoundationOne CDx(F1CDx) | 組織検体 |
| 2019年6月 | OncoGuide NCC オンコパネル | 組織検体 |
| 2021年8月 | FoundationOne Liquid CDx(F1LiquidCDx) | 血液検体(ctDNA) |
| 2023年7月 | Guardant360 CDx | 血液検体(ctDNA) |
| 2023年8月 | GenMineTOP | 組織 & 血液検体 |
それぞれの検査には 解析可能な遺伝子の範囲や特徴 に違いがあるため、状況に応じた選択が重要になります。
各CGP検査の特徴
FoundationOne CDx(F1CDx)/ FoundationOne Liquid CDx(F1LiquidCDx)
F1CDxは 組織検体 を、F1LiquidCDxは 血液検体(ctDNA) を対象に解析するCGP検査です。
🔍 特徴
- 324遺伝子を網羅的に解析可能
- 遺伝子変異(塩基置換、挿入/欠失、増幅、融合)に加え、MSIやTMBの測定も可能
- F1CDxは一部CDx機能を持ち、分子標的薬の適応判定にも使用
- すべての検体は米国FMI社に送付し、解析が行われる
📌 注意点
- F1LiquidCDxはコピー数変化の解析が不可
- NTRK3融合遺伝子は一部検出できないケースがある
OncoGuide NCC オンコパネル
NCCオンコパネルは、国立がん研究センター(NCC)が開発した ハイブリッドキャプチャーシークエンス法 を用いたCGP検査です。
🔍 特徴
- 124遺伝子の変異(塩基置換、挿入/欠失、増幅)を解析
- 13遺伝子の融合、MSI、TMBの測定が可能
- 正常細胞(血液検体)も同時に解析し、生殖細胞系列変異との区別が可能
- CDx機能は持たず、治療薬適応判定には使用不可
📌 特徴的な点
- まれな遺伝子多型の除外が可能
- 生殖細胞系列変異と体細胞変異を区別できる
Guardant360 CDx
血液検体(ctDNA)を用いるCGP検査 で、手術や生検が難しい患者でも検査可能です。
🔍 特徴
- 74遺伝子を解析
- KRAS G12C、HER2変異に対するCDx機能を持つ
- MSI-Highの検出が可能
📌 注意点
- 組織検体に比べて解析感度が低い場合がある
🔹 GenMineTOP がんゲノムプロファイリング
組織検体 + 血液検体を用いるCGP検査 で、より包括的な解析が可能。
🔍 特徴
- 737遺伝子 + TERTプロモーター領域の変異解析
- TMBスコア、455遺伝子の融合解析、エクソンスキッピング解析も可能
- 正常細胞(血液検体)との比較で、生殖細胞系列変異の特定も可能
📌 活用ポイント
- NSCLCに限らず、固形がん全般の詳細な遺伝子プロファイリングが可能
- 複数の検体(組織・血液)を組み合わせることで、より精密な解析ができる
CGPの課題
- 標準治療が終了しないと保険適用されない
- 早期からの遺伝子プロファイリングが難しい
- 治療薬に結びつく割合が約10%と低い
- 検査結果を活かせる選択肢が限られている
- エキスパートパネルでの検討が必要
- 治療戦略を立てるために専門家の関与が必須
小括
✅ CGPは、特定の遺伝子変異ではなく、包括的な遺伝子異常解析を目的とする
✅ 標準治療が終了(または終了見込み)になった患者が対象
✅ F1CDx、NCCオンコパネル、Guardant360 CDx、GenMineTOPなど複数の選択肢がある
✅ 治療薬に結びつく割合は約10%と低く、今後の課題
まとめ
最後に、臨床で特に意識すべきポイント を振り返りましょう!
- 分子標的治療は長期生存が期待できる治療法であり、適切な診断が不可欠
- 初回治療前の遺伝子検査(ドライバー遺伝子+PD-L1発現)は必須
- 周術期治療においても遺伝子情報を考慮する時代に
- 単一遺伝子検査からマルチ遺伝子検査(NGSなど)へのシフトが進行中
- 分子標的治療薬を使用するには、対応するマルチCDxが必須
- 適切な検査を行うためには、検体採取の段階から遺伝子診断を考慮する
- マルチCDxの特徴を理解し、患者の状況に応じて適切な検査を選択する
- AmoyDx(PCR)は迅速・高感度
- NGSベース(オンコマイン DxTT・肺がんコンパクトパネル)は包括的診断向き
- CGPは、特定の遺伝子変異ではなく、包括的な遺伝子異常解析を目的とする
- 新しい分子標的薬の承認とともに、診断すべき遺伝子も次々に増加しているため、最新の情報を常にアップデートする
今後も 肺癌診療は進化を続ける ため、最新の診断技術と治療法を理解し、最適な医療を提供できるようにしていきましょう!

2025/4/16追記;
第65回日本呼吸器学会学術講演会(2025年4月11~13日)のALK肺癌に関するセミナーにおいて、以下のようなコメントがありました。
「若年者でALK肺癌を疑う場合、Amoy法やコンパクトパネルよりもオンコマインパネルを用いる方が望ましいと考えられます。理由としては、オンコマインでは検出可能なALKバリアントの種類が多く、偽陰性のリスクを低減できるためです。なお、Amoy法などを使用する場合には、ALKの免疫染色(IHC)を併用することで、見逃しを防ぐ工夫が重要です。」
日本肺癌学会バイオマーカー委員会編 肺癌患者におけるバイオマーカー検査の手引き(2024年9月作成)付表2-1 「各コンパニオン診断法における報告対象バリアント:融合遺伝子」のページを参照

