ベーリンガーインゲルハイムのネランドミラスト、進行性肺線維症(PPF)/進行性線維化を伴う間質性肺疾患(PF-ILD)を対象とする第3相FIBRONEER™-ILD試験において主要評価項目を達成
和訳リリース, 2025年02月17日
ネランドミラスト、第3相FIBRONEER™試験で主要評価項目を達成!

- 2025年2月17日、ベーリンガーインゲルハイムは、開発中の新薬ネランドミラスト(一般名:nerandomilast、開発コード:BI 1015550)が、肺線維症を対象とした第3相臨床試験FIBRONEER™-ILD試験において主要評価項目を達成したと発表しました。
- 本試験は、進行性肺線維症(PPF)および進行性線維化を伴う間質性肺疾患(PF-ILD)の患者さんを対象とし、治療薬としての有効性と安全性を検証するものです。

- IPFやPPF、PF-ILDは、肺の線維化が進行し、呼吸機能が低下していく疾患群です。
- PF-ILDやPPFは独立した疾患ではなく、主にIPF以外の間質性肺疾患において線維化が進行する病態の包括的概念といえます。
- 現在、抗線維化薬としてピルフェニドンやニンテダニブが使われていますが、病気の進行を完全に止めることは難しく、新たな治療法が求められています。
- そんな中、ベーリンガーインゲルハイム社が開発中の「ネランドミラスト」は、新しいメカニズムを持つ優先的ホスホジエステラーゼ4B(PDE4B)阻害剤として期待されています。
- 今回は、PDE4という分子の働きや、この薬がどのようにIPF・PPFの治療に役立つのかを、できるだけわかりやすくお伝えしたいと思います。
FIBRONEER™試験とは?
ネランドミラストは、ホスホジエステラーゼ4B(PDE4B)を選択的に阻害する経口薬で、肺線維症の進行を抑える作用が期待されています。
FIBRONEER™試験は、肺線維症患者さんを対象とする2つの第3相臨床試験から成り立っています。
- FIBRONEER™-ILD試験
- 対象:PPFおよびPF-ILD患者
- 規模:40カ国以上、400都市、1,178名が参加
- 主要評価項目:52週時点での努力肺活量(FVC)のベースラインからの絶対変化量(mL)
- 主な副次評価項目:試験期間中に複合エンドポイントとして設定した、初回急性増悪、呼吸器疾患による初回入院、または死亡のいずれかが生じるまでの期間。
- まだ論文化はされていない。詳細は下記。
- FIBRONEER™-IPF試験(ベーリンガー社のホームページで公開<こちら>)
- 対象:特発性肺線維症(IPF)患者
- 規模:30カ国以上、330施設、1,177名が参加
- 主要評価項目:52週時点でのFVCの絶対変化量
- 主な副次評価項目:試験期間中に複合エンドポイントとして設定した、初回急性増悪、呼吸器疾患による初回入院、または死亡のいずれかが生じるまでの期間。
- まだ論文化はされていない。第二相試験の結果は論文化されている。詳細は下記。
第3相試験で良好な結果!
FIBRONEER™-ILD試験では、ネランドミラストはプラセボと比較し、肺機能(FVC)の低下を有意に抑制することが確認され、主要評価項目を達成しました。
また、FIBRONEER™-IPF試験でも、2024年9月に同様に主要評価項目を達成したことが発表されています。
両試験において、安全性および忍容性(副作用への耐性)も概ね良好で、第2相試験の結果と一致していることが確認されています。両試験とも、2025/2/20時点では論文化されておらず、ベーリンガー社のホームページ上で大まかな結果が公開されている状態です。
ちなみに、本薬剤以外にも、現在いくつかのIPFやPPFを対象とした臨床試験があり、有望な結果を示しています。
- 第2相試験:選択的αvβ6/αvβ1インテグリン阻害剤であるベクソテグラスト(Bexotegrast)
INTEGRIS-IPF臨床試験の結果は<こちら>

PDE4Bとは?
まず、「PDE」とはホスホジエステラーゼ(Phosphodiesterase)の略で、「cAMP」という細胞内の情報伝達物質を分解する酵素群のことです。
cAMPは、炎症を抑えたり、細胞の過剰な増殖を抑えたりする大事な役割を果たします。しかし、PDEが働きすぎるとcAMPが分解されてしまい、炎症や線維化が促進されることになります。
PDEには11種類以上のファミリーがありますが、その中でも「PDE4」というグループが、特に炎症や免疫反応に関わっています。さらにPDE4には、A・B・C・Dの4つのサブタイプがあります。
特にPDE4Bは、肺や免疫細胞(マクロファージなど)で炎症や線維化を促進する役割を担っていることが分かってきました。

ネランドミラストはPDE4Bをピンポイントで阻害する!
ネランドミラストは、「PDE4B」に選択的に働く薬です。
従来のPDE4阻害薬は、PDE4AやDも阻害してしまい、吐き気や嘔吐といった消化器系の副作用が問題になっていました。
しかし、ネランドミラストはPDE4Bだけを狙い撃ちすることで、
- 炎症性サイトカイン(TNF-α、IL-6など)の産生抑制
- 線維芽細胞の異常増殖抑制
- 肺胞上皮細胞・血管内皮細胞の保護
といった肺線維化の進行を抑える作用を持ちつつ、消化器症状などの副作用を減らせる可能性があります。
まだ第三相試験の結果の詳細は論文化されておらず不明なので、今回はIPFに対する第二相試験の論文の内容をおさらいしてみましょう。
Trial of a Preferential Phosphodiesterase 4B Inhibitor for Idiopathic Pulmonary Fibrosis.
Richeldi L, et al. N Engl J Med. 2022 Jun 9;386(23):2178-2187. doi: 10.1056/NEJMoa2201737.
研究の背景
- ホスホジエステラーゼ4(PDE4)阻害は、抗炎症および抗線維化作用と関連しており、特発性肺線維症患者に有益である可能性がある。
方法
- 本試験は第2相二重盲検プラセボ対照試験であり、PDE4Bサブタイプを選択的に阻害する経口薬BI 1015550の有効性および安全性を特発性肺線維症患者において検討したものである。
- 患者は、BI 1015550を18mg1日2回投与する群とプラセボ群に2:1の割合で無作為に割り付けた。
- 主要評価項目は、背景抗線維化薬の使用の有無に応じて層別化し、ベイズ法により12週時点の努力性肺活量(FVC)のベースラインからの変化量を評価することであった。
主な結果
- 合計147例がBI 1015550群またはプラセボ群に無作為に割り付けられた。
- 抗線維化薬を使っていなかった非使用群では、FVCの中央値変化量は、BI 1015550群で5.7mL(95%信用区間、−39.1~50.5)、プラセボ群で−81.7mL(95%信用区間、−133.5~−44.8)であり、中央値差は88.4mL(95%信用区間、29.5~154.2)であった。
→BI 1015550がプラセボよりも優れている確率は0.998であった。 - 抗線維化薬を使用していた群では、FVCの中央値変化量は、BI 1015550群で2.7mL(95%信用区間、−32.8~38.2)、プラセボ群で−59.2mL(95%信用区間、−111.8~−17.9)であり、中央値差は62.4mL(95%信用区間、6.3~125.5)であった。
→BI 1015550がプラセボよりも優れている確率は0.986であった。 - 反復測定混合モデル解析においても、ベイズ解析と一致した結果が示された。
- 最も頻度の高かった有害事象は下痢であった。
- 有害事象によりBI 1015550投与を中止した患者は13例であった。
- 重篤な有害事象または重度の有害事象を経験した患者の割合は、両群間で同程度であった。
結論
- 本プラセボ対照試験において、BI 1015550は単独投与であっても、抗線維化薬併用下であっても、特発性肺線維症患者における肺機能低下を抑制する効果を示した。
- (本試験はBoehringer Ingelheim社の資金提供を受けた;試験番号1305-0013、ClinicalTrials.gov登録番号NCT04419506)

- IPFに対するネランドミラストの第2相試験です。
- 一般的に、新しい薬が臨床で使用されるまでには、第1相→第2相→第3相→(承認後の第4相)といった複数の段階を経る必要があります。
- 特に、第2相試験は「薬の有効性(効果)の傾向と安全性を評価する」という重要なステップです。
- 第2相試験の目的はこの段階で明確な有効性を証明することではなく、有効性の”傾向”を評価し、安全性を確認することにあります。

この第二相試験では、BI 1015550(ネランドミラスト)は、IPF患者に対して12週間で肺機能低下を抑制する可能性を示しました。
背景抗線維化薬の有無にかかわらず効果が認められ、新しい治療選択肢として期待される結果となりました。結果を具体的に見てみましょう。
【結果:FVC変化量】
① 抗線維化薬を使っていない患者(非使用群)
- BI 1015550群:+5.7mL(95%信用区間 −39.1〜50.5)
- プラセボ群:−81.7mL(95%信用区間 −133.5〜−44.8)
→ 中央値差 +88.4mL(95%信用区間 29.5〜154.2)
→ BI 1015550が有効である確率:0.998
② 抗線維化薬を使っている患者(使用群)
- BI 1015550群:+2.7mL(95%信用区間 −32.8〜38.2)
- プラセボ群:−59.2mL(95%信用区間 −111.8〜−17.9)
→ 中央値差 +62.4mL(95%信用区間 6.3〜125.5)
→ BI 1015550が有効である確率:0.986
12週間という短期間ではありますが、FVC低下を抑えられたことは、IPF治療において前向きな結果です。
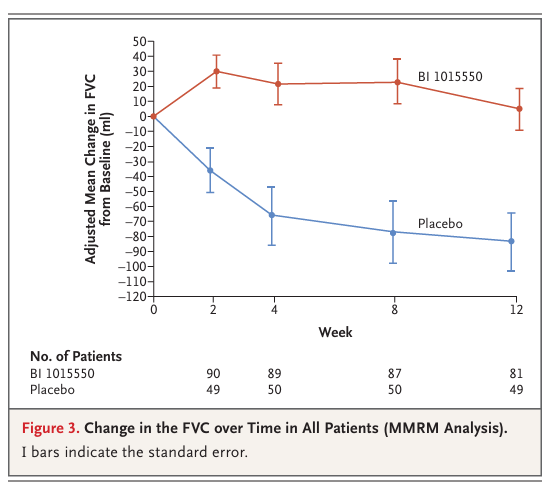
論文より引用
【安全性】
一方で、副作用として下痢などの消化器症状が多く報告されました。
特に抗線維化薬を併用している患者で治療中止例が目立つ点が課題です。
重篤な有害事象は両群で大きな差はありませんでしたが、BI 1015550群で死亡例が2例ありました。
(COVID-19肺炎と、IPF急性増悪+血管炎疑い。ただし血管炎は確定せず)

第二相試験のまとめです。
- BI 1015550はPDE4B選択的阻害薬として開発された新薬候補である。
- 特発性肺線維症(IPF)患者に対し、12週間でFVC低下抑制効果が示された。
- 抗線維化薬非使用群:中央値差 +88.4mL、有効確率 0.998抗線維化薬使用群:中央値差 +62.4mL、有効確率 0.986最も多い副作用は下痢などの消化器症状で、特に抗線維化薬併用群で中止例が目立った。
- 死亡例2例(COVID-19肺炎、IPF急性増悪+血管炎疑い)があったが、血管炎は未確認である。
- 12週間という短期間の試験であり、急性増悪・死亡・生活の質(QOL)など長期的影響は不明である。
- 第3相試験で長期有効性・安全性を確認する必要がある。
まとめ

- 上記の第二相試験の結果の解説が、今回の第三相試験の結果を理解する上での参考になれば幸いです。

◆今後の展望
今回の第三相試験の結果を受けて、ベーリンガーインゲルハイムは、FDA(米国食品医薬品局)をはじめとする世界各国でネランドミラストの新薬承認に向けた手続きを進めていくそうです。
さらに、FIBRONEER™-ILD試験とFIBRONEER™-IPF試験の詳しい結果も、2025年上半期から第2四半期にかけて発表される予定とのこと。今後の情報にも目が離せませんね。
肺線維症治療において、まさに新しい一歩が踏み出された印象ですね。これからどんな展開を見せてくれるのか、引き続き注目していきたいところです!

